|
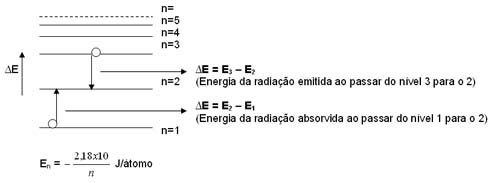
Átomo de Hidrogénio Espectro do átomo de hidrogénio Fórmula de Bohr Niels Bohr propôs uma interpretação do espectro descontínuo emitido por átomos. Para Bohr, as riscas deviam-se ao facto de as descargas eléctricas terem excitados os electrões do átomo, deixando-os em estados de energia (órbitas electrónicas bem definidas) mais elevados, absorvendo energia. Ao regressarem a níveis de energia mais baixos emitem essa radiação.
Níveis de energia e números quânticos O conceito de orbita foi substituído pelo conceito de orbital, isto é uma distribuição espacial do electrão em volta do núcleo. A cada orbital está associada uma determinada energia. As orbitais são caracterizadas pelos números quânticos. Existem 4 números quânticos: — O número quântico principal corresponde ao valor de energia de cada nível. Pode tomar valores inteiros (n= 1,2,3, etc.); — O número quântico secundário (l). Está relacionado com a forma da orbital e pode tomar valores inteiros que vão de 0 até n -1. Quando l=0, as orbitais designam-se por orbitais tipo s, apresentando forma esférica. Quando l=1, as orbitais dizem-se tipo p e têm uma forma lobular. Para l=2, as orbitais dizem-se do tipo d. — O número quântico magnético, designado por ml, que indica a orientação da orbital. Pode assumir valores inteiros que vão desde –l a +l. — O número quântico de spin, designado por ms, toma, para o electrão, os valores -½ ou +½. Tabela – Orbitais e respectivos números quânticos
Configurações electrónicas Uma orbital só pode conter no máximo, dois electrões e estes devem ter números quânticos de spin opostos. Quando preenchemos orbitais da mesma energia (como são as três orbitais de p) devemos fazer primeiro o semipreenchimento de cada uma, mantendo os electrões com o mesmo spin, e só depois proceder ao emparelhamento de spins (colocar electrões com spins opostos. Exemplo: 15P → 1s2, 2s2, 2p6, 3s2, 3p3 → Distribuição condensada Diagrama de caixa
Outros Resumos/Sebentas Relacionados
|
|