| | A atividade laboratorial realizada na disciplina de monitorização ambiental teve como objetivo a determinação da concentração exata de soluções previamente preparadas sendo elas, hidróxido de potássio, ácido clorídrico e ácido acético, recorrendo, assim, a uma titulação potenciométrica. Introdução teórica Existem várias formas de realizar uma titulação e vários tipos de titulações, neste trabalho experimental realizou-se uma titulação potenciométrica ácido/base. A titulação é um dos processos mais utilizados em química analítica quantitativa. É uma técnica volumétrica em que através da medição rigorosa de volumes é possível determinar a concentração de uma solução, utilizando outra solução cuja concentração é conhecida (solução padrão). Neste processo adiciona-se uma solução, que é colocada na bureta (titulante), à outra solução que se encontra no balão de Erlenmeyer (titulado) ocorrendo entre as duas, uma reação ácido-base.  O ponto de equivalência da reação é atingido quando o número de mol de iões H3O+, provenientes do ácido, iguala o número de mol de iões OH- provenientes da base. Do ponto de vista prático, a deteção do ponto de equivalência pode ser feita usando um indicador ácido-base apropriado, que, mudando de cor para um valor de pH, o mais próximo possível do ponto de equivalência, assinala o fim da titulação. No entanto, existem outros processos de deteção deste ponto, como o uso de um medidor de pH (método potenciométrico) ou a medição da condutividade elétrica do titulado (método condutimétrico). No método potenciométrico recorre-se a um elétrodo, sendo que no trabalho em questão o elétrodo utilizado foi um elétrodo combinado que contém um elétrodo de vidro e um elétrodo de referência de calomelano saturado combinados numa única unidade, formando uma peça de equipamento que é mais robusta para se introduzir e suportar na solução a ensaiar. O princípio no uso deste elétrodo está, basicamente, na sua membrana de vidro. Quando esta é imersa numa determinada solução, desenvolve-se um potencial que é uma função linear da concentração de hidrogénio na mesma. Substancia primária: Para que seja possível a determinação da concentração exata de uma substância em solução, sem ser necessário recorrer a titulações ou outros processos, é necessário que essa mesma substância obedeça a certos critérios, sendo eles: · Poder obter-se em estado quimicamente puro, isto é, não conter impurezas em quantidades tais que possam influenciar a precisão da análise (a percentagem de impurezas tem de ser inferior a 0,05%); · Tem de ser estável, quer no estado sólido, quer em solução, isto é, não deve reagir facilmente com outras substâncias; · Deve ser fácil de secar e não ser higroscópica. Além destas condições, deve-se ainda escolher as substâncias de maior massa molecular, pois isso diminui o erro relativo cometido na pesagem, aumentando assim a precisão da análise. As substâncias que satisfazem as condições acima mencionadas são designadas substâncias primárias. Estas substâncias normalmente são utilizadas na titulação de soluções em que a sua concentração exata é desconhecida. Material · Titulador potenciométrico; · Balança analítica; · Hidróxido de potássio; · Hidrogeno ftalato de potássio; · Ácido acético; · Ácido clorídrico; · Azul Bromotimol; · Fenolftaleína; . Balões volumétricos de 200,00 mL e 250,00 mL; · Solução tampão de pH 4 e 7; · Espátula; · Gobelés; · Pipeta graduada; · Varetas; Procedimento Iniciou-se o trabalho prático pela realização de cálculos necessários à preparação das soluções a titular. O objetivo principal do trabalho era a titulação de uma base forte com um ácido forte, assim como a titulação da mesma base forte com um ácido fraco. A base escolhida foi o hidróxido de potássio, porém esta solução não sendo uma substancia primária necessita de ser previamente titulada com uma outra solução de concentração exata conhecida. Após a preparação de hidrogeno ftalato de potássio (substância primária) e titulação da solução de KHO, procedeu-se à titulação das soluções ácidas. Para realizar estas titulações é necessário pipetar 15,00 mL de cada solução ácida para um gobelé de 100 mL, juntando 5 gotas de indicador, e preparar uma bureta com KHO padronizado. É também essencial efetuar a calibração e condicionação dos eléctrodos presentes no titulador potenciométrico com soluções tampão de pH 4 e 7. Depois da preparação do material inicia-se a titulação, em que se mede o pH da solução titulada após adições sucessivas de 1 mL de titulante. Aquando do fim da titulação traçam-se os gráficos da curva de titulação, e determinam-se os pontos finais, calculando, desta forma, a concentração rigorosa das soluções. Cálculos efetuados na preparação das soluções: V= 200,00 mL M (C8O4H5K)= 204,22 g/mol [C8O4H5K]= 0,1 mol/L [C8O4H5K]=![]() ![]() m = n x M mteórica = 0,020 x 204,22 <-> m = 5g C8H5O4K mpesada = 5,1505g n=![]() n= 0,02522 mol n= 0,02522 mol [C8O4H5K]= ![]() [C8O4H5K]= 0,12610 mol/L [KHO]= 0,1mol/L V= 250,00 mL %m/m= 85% n= [KHO] x V <-> n= 0,1 x 250,00 <-> n= 0,025 mol m= 0,025 x 56,11 <-> m= 1,4g KHO 1,4g ----------------> 85% x --------------------> 100% x=1,6g KHO M (CH3COOH)= 60,06 g/mol [CH3COOH] = 0,1 mol/L r= 1,05 g/ml V= 200,00 mL n= 0,1 x 200,00 x ![]() <-> n= 0,02 mol <-> n= 0,02 mol m= 0,02 x 60,06 <-> m= 1,20g V= ![]() <-> V= <-> V= ![]() <-> V= 1,14 mL CH3COOH <-> V= 1,14 mL CH3COOH Nota: não foram necessários cálculos para a preparação da solução de HCL, pois esta já se encontrava preparada. Resultados KHO - C8O4H5K KHO- CH3COOH KHO-HCL | pH | mL | pH | mL | pH | mL | | 4,02 | 0 | 2,89 | 0 | 0,85 | 0 | | 4,2 | 1 | 3,63 | 1 | 0,89 | 1 | | 4,35 | 2 | 3,93 | 2 | 0,93 | 2 | | 4,51 | 3 | 4,18 | 3 | 0,97 | 3 | | 4,68 | 4 | 4,34 | 4 | 1,02 | 4 | | 4,77 | 5 | 4,48 | 5 | 1,07 | 5 | | 4,88 | 6 | 4,62 | 6 | 1,12 | 6 | | 5,01 | 7 | 4,75 | 7 | 1,18 | 7 | | 5,1 | 8 | 4,86 | 8 | 1,24 | 8 | | 5,19 | 9 | 4,99 | 9 | 1,3 | 9 | | 5,3 | 10 | 5,11 | 10 | 1,38 | 10 | | 5,39 | 11 | 5,25 | 11 | 1,46 | 11 | | 5,51 | 12 | 5,41 | 12 | 1,54 | 12 | | 5,63 | 13 | 5,62 | 13 | 1,63 | 13 | | 5,76 | 14 | 5,91 | 14 | 1,72 | 14 | | 5,94 | 15 | 6,44 | 15 | 1,86 | 15 | | 6,16 | 16 | 11,71 | 16 | 2,04 | 16 | | 6,53 | 17 | 12,3 | 17 | 2,28 | 17 | | 7,8 | 18 | 12,53 | 18 | 2,88 | 18 | | 11,94 | 19 | 12,68 | 19 | 11,5 | 19 | | 12,31 | 20 | 12,79 | 20 | 12,19 | 20 | | 12,5 | 21 | 12,88 | 21 | 12,45 | 21 | | 12,65 | 22 | 12,95 | 22 | 12,6 | 22 | | 12,75 | 23 | 13 | 23 | 12,72 | 23 | | 12,84 | 24 | 13,05 | 24 | 12,81 | 24 | | 12,91 | 25 | 13,08 | 25 | 12,88 | 25 | Tratamento de resultados  Veq = 18mL V C8O4H5K= 15,0 mL KHO(aq) + C8O4H5K(aq) -> C8O4H5K2(aq) + H20 (l) [C8O4H5K] = 0,12610 mol/L n( ![]() =n (KHO) =n (KHO) n= 0,12610 x 15,00 x ![]() <-> n= 1,892 x <-> n= 1,892 x ![]() mol mol [KHO] = 0,1051 mol/L 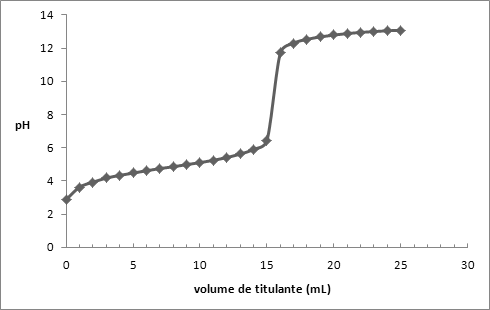 Veq.=16 mL VCH3COOH=15 mL CH3COOH (aq) + KHO (aq) -> CH3COOK (aq) + H2O(l) ![]() ![]()  Veq.=18,2 mL VHCl=15 mL KHO(aq) + HCL (aq) -> KCL (aq) + H2O (aq) ![]() ![]() Conclusão Através deste trabalho prático foi possível determinar a concentração exata de todas as soluções preparadas através das titulações realizadas. O tipo de titulação que se realizou foi uma titulação potenciométrica, para tal recorreu-se ao titulador potenciométrico presente no laboratório. É possível concluir que o trabalho correu como planeado, o único obstáculo encontrado foi apenas a leitura das instruções de calibração, visto que se encontravam em francês. No entanto, não foram sentidas outras quaisquer dificuldades. Assim, a concentração das soluções foram as seguintes: · [KHO] = 0,1051 mol/L; . ![]() 0,1121 mol/L; 0,1121 mol/L; · [HCl] = 0,1275 mol/L. __________________________________ Outros Trabalhos Relacionados | | Ainda não existem outros trabalhos relacionados | | |