|
OBJECTIVOS . Determinar a concentração de uma solução de carbonato de sódio (Na2SO3; . Neutralizar uma solução aquosa de Na2CO3 com HCl(aq), fazendo uma titulação base fraca/ácido forte; . Medir o pH da solução ao longo do processo e traçar a curva de titulação com o intuito de identificar as zonas com efeito tampão; . Utilizar diferente material de laboratório tal como a placa com agitação magnética ou o medidor electrónico de pH pondo em prática os conhecimentos teóricos já adquiridos. PROTOCOLO EXPERIMENTAL Material Equipamento
Reagentes
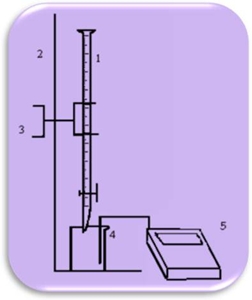
Procedimento 1. Preparou-se uma bureta de 25 mL com a solução de ácido clorídrico 0,10 mol.dm-3; 2. Mediu-se 10 cm-3 de solução de carbonato de sódio de concentração 0,10 mol.dm-3 para um gobelé e adicionou-se 50 cm-3 de água destilada. Colocou-se a barra magnética dentro do gobelé; 3. Adicionou-se 2 a 3 gotas de fenolftaleína; 4. Lavou-se o eléctrodo; 5. Introduziu-se o eléctrodo do medidor de pH dentro do copo e ligou-se o agitador magnético tendo o cuidado de, ao rodar, a barra não tocar no eléctrodo; 6. Mediu-se e registou-se o valor de pH antes da titulação, assim como a temperatura; 7. Adicionou-se o titulante por incrementos sucessivos de 0,5 cm-3. Mediu-se o valor de pH depois de cada titulação até se encontrar o primeiro ponto de equivalência; 8. Registou-se o volume (V1) de titulante gasto; 9. Adicionou-se 2 a 3 gotas de alaranjado de metilo para encontrar o segundo ponto de equivalência; 10. Continuou-se a adicionar a solução de HCl e a medir o volume e o pH do titulado, até mudança de cor para rosa. Anotou-se o volume gasto (V2); 11. Repetiram-se os ensaios duas vezes; 12. Esvaziou-se e lavou-se convenientemente a bureta. Esquema de montagem
Legenda 1 – Bureta com solução de HCl (0,1M) 2 – Suporte Universal 3 – Garra para buretas 4 – Gobelé com solução de Na2CO3 5 – Medidor de pH
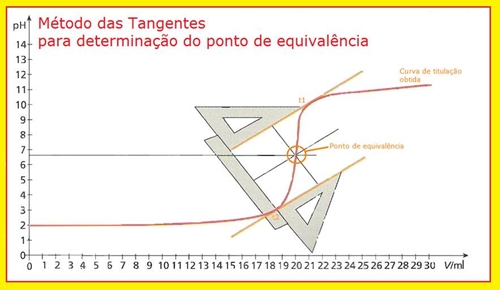
Fig.1 Titulação base fraca/ácido forte. Adição de HCl a Na2CO3, com o auxílio do medidor de pH. INTRODUÇÃO O processo de titulação consiste numa reacção de neutralização que ocorre entre um ácido e uma base dando origem a um sal e água, traduzindo-se na reacção genérica: ácido + base ¾¾® sal + água. Assim, a titulação, ou volumetria de ácido-base, é uma técnica de análise quantitativa que consiste na determinação da concentração de uma solução (titulado) através da sua reacção com outra solução de concentração conhecida (titulante). Com a actividade prática realizada pretendeu-se determinar a concentração de uma solução aquosa de Na2CO3, por titulação de uma base fraca com um ácido forte (solução-padrão de HCl). Neste tipo de titulações (base fraca/ácido forte ou vice-versa) há uma fase, antes do ponto de equivalência, em que acréscimos consideráveis de titulante provocam variações de pH diminutas tratando-se então de um efeito tampão. O estudo destas soluções assume actualmente um papel preponderante em áreas de interesse biológico. Por exemplo, os tampões CO2/HCO3- e H2PO4-/HPO42- são deveras importantes para a manutenção do pH do sangue e dos líquidos intracelulares, respectivamente. Posteriormente, pretendeu-se igualmente traçar a curva de titulação para cada um dos ensaios determinando-se assim o pH no ponto de equivalência e identificando as zonas com efeito tampão. A detecção do ponto de equivalência determina-se adicionando, gradualmente, pequenas quantidades do titulante ao titulado, até a reacção química entre as suas soluções ser praticamente completa. É nesse momento que se diz que se atingiu o ponto de equivalência da titulação embora o que seja realmente detectado é o ponto final através da variação brusca de uma propriedade física ou química do titulado. Esta detecção visual é possível através da mudança de cor de uma substância adicionada, designada por indicador. Nesta actividade experimental utilizámos a fenolftaleína e o alaranjado de metilo cujos valores da zona de viragem são os seguintes: Zona de Viragem (pH) û Fenolftaleína – 8.2 a 10 û Alaranjado de metilo – 3.2 a 4.4 Por outro lado, também um medidor de pH pode ser usado para determinar o ponto de equivalência. Deste modo, na actividade prática realizada aliámos estes dois processos. Neste segundo caso, é necessário ter em atenção o manuseamento do equipamento bem como a leitura dos valores, atendendo à sensibilidade do aparelho. Com os valores de pH recolhidos para cada volume de titulante adicionado, traçou-se as curvas de titulação para cada um dos ensaios. Para determinar o ponto de equivalência que se situa na zona de viragem dos respectivos indicadores, usou-se o método das tangentes. Este processo consiste em: 1º Traçar duas tangentes à curva (t1 e t2), paralelas, e situadas de um lado e de outro do ponto de equivalência. 2º Traçar, em seguida, uma paralela a estas duas tangentes, equidistante delas; a sua intersecção com a curva define o ponto de equivalência.
Fig.2 Determinação gráfica do ponto de equivalência. Relativamente aos reagentes, utilizámos como titulante ácido clorídrico e, como base, uma solução de carbonato de sódio. Importante é também referir que, aquando da concretização desta actividade experimental, certos cuidado deverão ser tomados em conta evitando discrepâncias falaciosas, como seja a eliminação de bolhas de ar, respeitar os algarismos significativos ou o simples facto de fazer as leituras dos aparelhos correctamente, atendendo à sua sensibilidade. RESULTADOS, CÁLCULOS E DISCUSSÃO
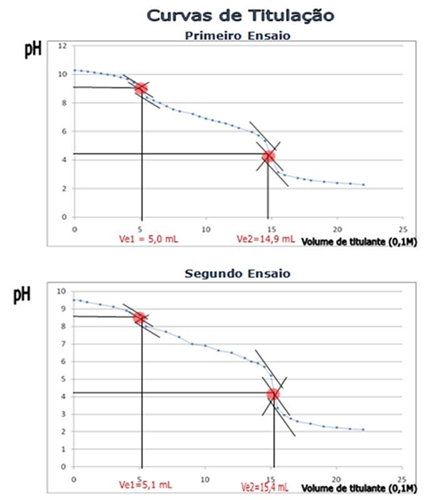
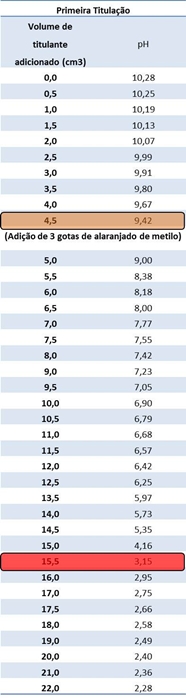
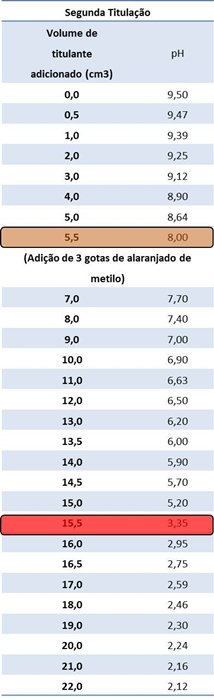
Tabelas I e II: Resultados obtidos relativamente à primeira e segunda titulação, respectivamente.
Mudança de cor do
alaranjado de metilo de amarelo para rosa.
Gráficos I e II: Curvas
de titulação correspondentes à primeira e segunda titulação,
respectivamente.
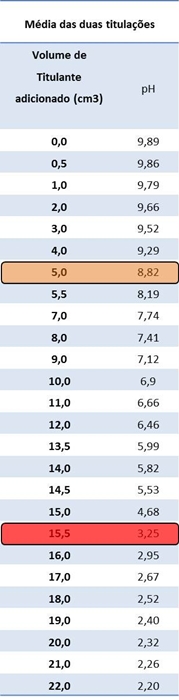
Tabela III: Média dos resultados obtidos relativamente à primeira e segunda titulação,
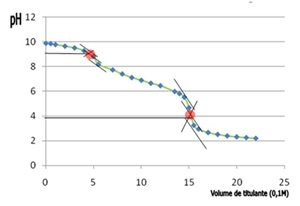
Gráfico III: Curva de titulação correspondente à média dos valores obtidos nas duas titulações realizadas, respectivamente. Sabemos que, na presença de água, o ácido clorídrico se comporta do seguinte modo: HCl (aq) + H2O (l) ¾® H3O+ (aq) + Cl-(aq), sendo que o ião cloreto é um ião espectador já que é uma base conjugada de um ácido muito forte.
Por sua vez, a equação respeitante à dissociação do carbonato de sódio é a seguinte: Na2CO3 (aq) ¾H2O® 2 Na+ (aq)+ CO32- (aq) O Na+ é um ácido conjugado de uma base muito forte, pelo que, tal como o cloreto, se vai comportar como um ião espectador. Deste modo, é o ião CO32- que vai reagir com o ácido clorídrico: Numa primeira fase, dá-se a conversão do carbonato em hidrogenocarbonato:
H3O+(aq) + CO32- (aq) ¾® HCO3-(aq) + H2O (l) (quando em proporções estequiométricas, dá-se o primeiro ponto de equivalência)
Numa segunda fase, dá-se a conversão do hidrogenocarbonato em ácido carbónico:
H3O+(aq) + HCO3-(aq) ¾® H2CO3 (aq) + H2O (l) (quando em proporções estequiométricas, dá-se o segundo ponto de equivalência)
Por sua vez, para calcular a concentração da solução de carbonato de sódio, utiliza-se a seguinte expressão válida no ponto de equilíbrio da reacção: na=nb logo, ca x Va = cb x Vb Para tal, temos os seguintes dados: Cácido = 0,10M
Vácido =
volume de titulante adicionado cbase = ? Vbase = 0,10 cm3 Para cada ensaio, os resultados obtidos estão expressos na tabela seguinte:
Tabela IV: Cálculo da
concentração da solução de carbonato de sódio através dos pontos de
equivalência de cada titulação. O primeiro ponto de equivalência para o primeiro e segundo ensaios correspondeu a um pH de 9,1 e 8,6, respectivamente, os quais são superiores ao valor esperado (8,3). Também no segundo ponto de equivalência, os valores obtidos para o pH da solução (4,2 e 4,1) são superiores ao esperado (3,7). Relativamente à concentração calculada para a solução de carbonato de sódio há discrepâncias em relação aos valores esperados, mas não entre os dois ensaios. Assim, fazendo os cálculos, a concentração calculada da solução de Na2CO3, foi de 0,15 mol.dm-3, um valor ligeiramente superior ao teórico (0,10 mol.dm-3) Os ensaios foram realizados a uma temperatura aproximada de 18ºC, pelo que, de certa forma poderá justificar que os resultados obtidos não sejam exactamente iguais ao previsto. Um aspecto também a mencionar é que o volume gasto para atingir o segundo ponto de equivalência deveria ter sido sensivelmente o mesmo que o primeiro, o que não aconteceu. Deste modo, pode-se afirmar que ocorreu um erro no cálculo do primeiro ponto de equivalência que terá tido origem em incorrectos registos de valores para o volume de titulante ou ainda da leitura incorrecta do gráfico obtido o que é menos provável. Também a pureza dos reagentes pode ser posta em causa. NOTA: Na realização desta actividade laboratorial foi necessário tomar especial cuidado no manuseamento do ácido clorídrico visto que este em contacto com a pele poder causar irritação cutânea. CONCLUSÃO Através da análise dos gráficos de titulação é possível concluir que as zonas com efeito tampão são: no gráfico I, correspondentes aos intervalos 0 a 4, 7 a 14 e 16 a 22 de volume de titulante adicionado; no gráfico II, correspondentes aos intervalos 0 a 5, 6 a 14 e 17 a 22 de volume de titulante adicionado; no gráfico III, correspondentes aos intervalos 0 a 4, 7 a 14 e 16 a 22 de volume de titulante adicionado; nestas zonas existe igual quantidade de Na2CO3 e de um sal do seu ácido conjugado, nas proporções estequiométricas. Pode-se igualmente concluir que os indicadores utilizados foram os mais indicados já que a zona de viragem contém o valor do pH para o ponto de equivalência o que, atendendo ao erro de titulação, nos permitiu confirmar que foi naquela altura e para aquele volume que se atingiram as proporções estequiométricas de cada uma das reacções em cima referidas. Apesar de discrepâncias em relação aos valores inicialmente esperados, estas que se devem à ocorrência de erros experimentais sistemáticos como sejam incorrectas leituras, medições ou variações ambientais como a temperatura que condiciona a extensão da reacção, conclui-se que a concentração da solução de carbonato de sódio é de 0,15 mol.dm-3. Referências Bibliográficas I. VICTOR GIL e JOÃO PAIVA, Texto Editores, «12Q-Química, 2008» (páginas 139-141), II. Parte II : Reacções ácido-base - conceitos e experiências, Prof. Jorge Paiva, Universidade de Aveiro (página 7) Outros Trabalhos Relacionados
|
|
 Mudança de cor da fenolftaleína de carmim para incolor.
Mudança de cor da fenolftaleína de carmim para incolor.