|
Introdução
Assim sendo, podemos classificar as soluções aquosas em três grupos: . Soluções acidas . Soluções neutras . Soluções básicas Numa solução aquosa existem permanentemente iões H3O+ e iões OH – devido á auto-protólise da agua representada pela equação:
H2O
(l) + H2O
(l)
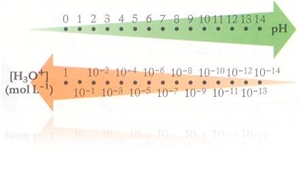
Quando, numa solução aquosa: . [H3O+] = [OH-] – a solução é neutra . [H3O+] > [OH-] – a solução é ácida . [H3O+] < [OH-] – a solução é básica
O pH de uma solução serve essencialmente para caracterizar as soluções aquosas. O valor do pH em soluções aquosas vulgares está compreendido entre 0 e 14 e não tem unidades. O pH de uma solução é definido a partir da concentração em iões H3O+ dessa solução, expressa em mol dm-3, através da relação: [H3O+] = 10-pH - pH = -log [H3O+] Quanto maior for o carácter ácido de uma solução, ou seja, quanto maior for a sua concentração em iões H3O+, menor será o valor do seu pH.
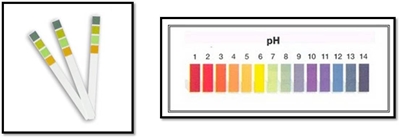
Para determinar o pH de uma solução, a classificação das soluções ácidas alcalinas ou neutras pode ser feita através de vários processos. A avaliação pode ser aproximada, utilizando o indicador universal, ou rigorosa, utilizando o medidor de pH electrónico, antecipadamente calibrado, ou outros sensores. O papel indicador de pH, simplesmente conhecido como papel de pH, é um papel impregnado com uma mistura de vários indicadores ácido-base cuja cor varia com o pH da solução, permitindo, assim, estabelecer uma escala corada de pH. Há vários tipos de papel de pH, e o papel de pH adquire uma cor bem definida quando fica em contacto com uma solução de pH compreendido num intervalo de valores determinado. Este método é rápido e pratico mas de leitura aproximada.
Se utilizarmos o aparelho medidor de pH conseguimos saber com precisão o valor de pH de uma solução aquosa. Existem vários tipos de medidores de pH mas, no geral, estes aparelhos são constituídos por duas partes essenciais: um voltímetro e uma sonda (um eléctrodo de vidro e um eléctrodo de referência). Os medidores de pH digitais indicam directamente o valor de pH, uma vez mergulhados na solução a testar.
As características da água doce existente nos lagos, albufeiras, lagoas, rios e em lençóis de água subterrâneas condicionam a utilização dessas águas.
Um consumidor deve ler o rótulo das garrafas de água antes de as adquirir, de modo a escolher a que mais lhe convier. Uma das indicações presentes em qualquer rótulo de uma garrafa mineral é o valor do seu pH. O carácter mais ou menos ácido de uma água está relacionado com as características geológicas da região onde essa água é captada. A medição do pH de uma água deve ser feita preferencialmente no local de recolha. Caso tal não seja possível, a água deve ser transportada para o laboratório de análises em frascos de recolha apropriadas. Pela sua diversidade geológica, o nosso país é muito rico em águas minerais e a maior parte das fontes de águas minerais encontra-se no norte do país. Objectivo da experiência O objectivo de toda esta experiência é identificar e verificar o carácter ácido, básico ou neutro de diferentes tipos de águas. Como por exemplo a água desionizada, a água Luso, água da chuva, água Dia, águas carbonatada, água gaseificada e água da torneira. Os problemas desta experiêcnia são: 1. Será que a água que se bebe, seja água da torneira ou água de mesa engarrafada, apresenta sempre o mesmo valor de pH? 2. Será que o valor da temperatura tem influência no valor do pH de uma água? Materiais . Papel indicador de pH; . Gobelé (5x); . Suporte universal; . Esguicho; . Tubo de ensaio (5x); . Termómetro; . Aparelho de medição de pH; . Indicadores de pH (4): - Azul de bromotimol - Timolftaleína - Vermelho de fenol - Alaranjado de metil . Indicador universal de pH; . Pipeta; . Suporte para tubos de ensaio; . Placa de aquecimento; . Água da torneira; . Água desionizada; . Água Luso; . Água Dia; . Água da chuva; . Água gaseificada; . Água carbonatada. Rótulos das águas utilizadas
* As águas assinalados com um asterisco não têm rótulo e os valores apresentados são os esperados para cada caso. Procedimento experimental Primeira Parte 1. Preparar as sete águas diferentes em gobelés diferentes; 2. Iniciar a experiência com uma água à escolha (a que daremos o nome de água A); 3. Medir a temperatura da água e registá-la; 4. Medir o pH com o auxílio do aparelho de medição e registar os resultados; 5. Medir o pH com o auxílio do papel medidor de pH e registar os resultados; 6. Distribuir a água A por cinco tubos de ensaio diferentes, previamente lavados com a água da referida experiência; 7. Adicionar a cada tubo de ensaio duas gotas de cada um dos quatro indicadores de pH mais o indicador universal; 8. Observar a cor e registar os resultados; 9. Repetir os passos anteriores para as restantes águas. Segunda Parte 1. Coloque a água A num gobelé e aqueça-a numa placa de aquecimento; 2. De cada cinco em cinco graus celsius registe o pH da água com o aparelho de medição; 3. Refaça os passos anteriores para as restantes águas; 4. Compare os resultados do pH a temperatura ambiente e do pH a temperatura alterada. Resultados Tabela de resultados com indicadores
Tabela de resultados com papel e aparelho medidor de pH
Tabela de resultados com temperaturas alteradas
Discussão Primeira Parte Água do Luso No caso da água do Luso, o valor de pH esperado deveria ser de 5,64, no entanto, o valor obtido através do aparelho medidor de pH foi de 7 e o mesmo valor para o papel. O que nos mostra que o rótulo não está de acordo com o real pH da água. Os restantes indicadores de pH são demasiado subjectivos, no entanto, também eles nos dão informações diferentes das do rótulo. Exeptuando o azul de bromotimol e a timolftaleína que nos dão os valores esperados. Atendendo à maioria dos resultados contra o rótulo, iremos considerar que o rótulo da garrafa de água do Luso se encontra errado. Água Dia No caso da água Dia, o valor de pH esperado deveria de ser de 5,5, no entanto, o valor obtido através do aparelho medidor de pH foi de 6,8 e 8 para o papel. O que nos mostra que o rotulo não está de acordo com o real pH da água. Os restantes indicadores indicam-nos valores entre os 5,5 e os 6,8. Assim sendo devemos ignorar o valor para o papel e considerar que o pH real da água Dia se encontra mais ou menos dentro do esperado, com uma margem de erro de + 1,3. Água da Chuva No caso da água da chuva, o valor de pH esperado era de 5,6 porém temos que considerar a localização onde a água foi capturada e as condições na altura da captura. No entanto, os valores para o aparelho de medição foram muito próximos (5,8) e para o papel tivemos uma margem de erro de + 0,9. Nos restantes indicadores o valor esteve sempre muito próximo de 6. Água Carbonatada No caso da água carbonatada, o valor esperado esteve completamente longe das nossas medições, sendo que o aparelho de medição nos indicou 7,3 e o papel 7 quando na realidade seria de esperar entre 3 e 4. Os restantes indicadores mostram-nos valores entre 7 e 8. O que nos leva a concluir que a nossa fonte de informação à cerca desta água em particular está errada. Água da torneira Esta é a única água para a qual não estabelecemos um valor inicial para o seu pH, uma vez que varia conforme a região. No entanto, os valores observados foram todos entre 5,8 e 6 para os indicadores de cor, 7,5 para o aparelho medidor e 6 para o papel medidor de pH. Mas como foi dito em cima, o valor varia de região para região, tomando em conta os componentes de cada água. Água gaseificada No caso da água gaseificada, estabelecemos um valor de pH de 6,1 e tanto o aparelho medidos de pH (6,8) como o papel (7) nos deram um valor relativamente próximo do esperado. Em relação aos restantes indicadores o valor foi também bastante próximo ao esperado, estando entre 6 e 7. Água desionizada A água desionizada é considerada a água pura, ou seja, deverá ser uma água neutra de pH 7. Tal pH foi comprovado tanto pelo aparelho de medição (7,1) como pelo papel (6,5). No caso dos indicadores também obtivemos uma resposta positiva ao que esperavamos. Segunda Parte O pH depende da temperatura. Por isso, quando medimos o pH, devemos registar a temperatura a que o fazemos, pois só podemos comparar valores de pH medidos à mesma temperatura. Alguns medidores de pH fazem uma compensação automática de temperatura. De acordo com o princípio de Le Châtelier, quando se alteram as condições da reacção que se encontram em equilíbrio, a reacção irá evoluir no sentido de contrariar a essas alterações. Assim quando se eleva a temperatura da água , o equilíbrio: 2H2O(l) H3O (aq) + HO- (aq) Evoluirá de forma a diminuir a temperatura (absorvendo a energia do meio exterior). Como a constante de ionização da água: (Kw)= [H3O+] [HO-] Aumentou, então pode concluir-se que as concentrações [H3O+ ] e [HO¯ ] também aumentaram. Isto significa que a reacção é endométrica e o pH da água diminui com a temperatura. Com a nossa experiência em relação à água da torneira aconteceu precisamente o oposto, a temperatura aumentou assim como o pH da água em questão. Esta situação pode dever-se à má medição da temperatura ou mau uso do aparelho medidor de pH. No caso da água da chuva, pensamos que devemos desprezar os primeiros dois valores (que se encontram abaixo do terceiro). No entanto, a partir do terceiro valor a temperatura baixo ou mantem-se constante. Conclusão Com este trabalho podemos concluir que:
No caso da alteração de temperaturas, concluímos que na experiência relativa à água da torneira cometemos um erro na medição do pH e que na experiência relativa à água da chuva devemos ignorar os dois primeiros resultados, os restantes estão de acordo com a teoria de que o pH diminui com o aumento da temperatura. Respondendo aos problemas colocados no ínicio do trabalho 1. Será que a água que se bebe, seja água da torneira ou água de mesa engarrafada, apresenta sempre o mesmo valor de pH? R. Acreditamos que não, uma vez que os rótulos das garrafas de água de mesa são diferentes dos valores que obtivemos após a nossa medição. A causa para esta alteração poderá dever-se ao facto de a água ser capturada em diferentes alturas e de ser capturada em fontes de águas naturais minerais, ou seja, embora haja um controlo da qualidade da água, pode haver variação do pH. 2. Será que o valor da temperatura tem influência no valor do pH de uma água? R. A resposta a esta questão é claramente sim, embora uma das nossas experiências nos tenha dado a ideia oposta. No entanto temos que tomar em consideração aquilo que foi dito na discussão: Quando se eleva a temperatura da água , o equilíbrio: 2H2O(l) H3O (aq) + HO- (aq) Evoluirá de forma a diminuir a temperatura (absorvendo a energia do meio exterior). Como a constante de ionização da água: (Kw)= [H3O+] [HO-] Aumentou, então pode concluir-se que as concentrações [H3O+ ] e [HO¯ ] também aumentaram. Isto significa que a reacção é endométrica e o pH da água diminui com a temperatura. Bibliografia . Dantas, Maria da Conceição; Ramalho, Marta Duarte – “Jogo de partículas, Química A do 11ºano – Caderno de actividades laboratoriais”; Texto Editores . Simões, Teresa Sobrinho; Queirós, Maria Alexandra; Simões, Maria Otilde – “ Química em contexto, Química 11”; Porto Editora Outros Trabalhos Relacionados
|
|
 Quando ingerimos uma
bebida utilizamos muitas vezes o termo ácido e, algumas vezes, o termo
neutro. Por exemplo, uma água gaseificada, uma limonada e uma Coca-Cola
têm sabor ácido. Quanto a uma água mineral não gaseificada dizemos que o
seu sabor é neutro. Um exemplo de outro tipo de solução é quando para
tomarmos banho, por vezes, utilizamos soluções de água ensaboada que são
frequentemente básicas. Existe ainda substâncias, como o açúcar e o
cloreto de sódio, cujas soluções aquosas não apresentam carácter
alcalino ou ácido, são soluções neutras.
Quando ingerimos uma
bebida utilizamos muitas vezes o termo ácido e, algumas vezes, o termo
neutro. Por exemplo, uma água gaseificada, uma limonada e uma Coca-Cola
têm sabor ácido. Quanto a uma água mineral não gaseificada dizemos que o
seu sabor é neutro. Um exemplo de outro tipo de solução é quando para
tomarmos banho, por vezes, utilizamos soluções de água ensaboada que são
frequentemente básicas. Existe ainda substâncias, como o açúcar e o
cloreto de sódio, cujas soluções aquosas não apresentam carácter
alcalino ou ácido, são soluções neutras.

 Antes de chegar às nossas
casas, a água recolhida é submetida a numerosos tratamentos físicos e
químicos, bem como a exames microbiológicos. A recolha da água que vai
ser submetida a uma análise que obedece também a varias normas.
Antes de chegar às nossas
casas, a água recolhida é submetida a numerosos tratamentos físicos e
químicos, bem como a exames microbiológicos. A recolha da água que vai
ser submetida a uma análise que obedece também a varias normas.