|
Introdução teóricaEste relatório de foi realizado no âmbito disciplinar de Física e Química A, solicitado pela professora x, após a realização de uma aula prático-laboratorial acerca da preparação de soluções. Em, primeiro lugar convém, então, salientar que o manuseamento de reagentes implica o conhecimento das normas de segurança a respeitar, bem como as propriedades próprias do soluto, que obrigam a procedimentos particulares, nomeadamente o uso de luvas e de bata. O soluto que se utilizou nesta atividade prático-laboratorial é um composto denominado sulfato de cobre penta-hidratado, cuja fórmula química é CuSO4.5H20. O Sulfato de Cobre (II) ou Sulfato Cúprico é um composto químico cuja fórmula molecular é: CuSO4. Este sal existe sob algumas formas, que diferem pelo seu grau de hidratação. Deste modo, este é geralmente encontrado na sua forma penta-hidratada (CuSO4.5H2O), sendo um sólido cristalino, de cor azul-escura. Portanto, nesta actividade laboratorial procedeu-se à diluição de uma concentração, procedimento este que consiste na adição de solvente a uma solução a fim de que se torne menos concentrada. Para isso, iniciou-se a noção de factor de diluição, ou por outras palavras, a relação entre o volume da solução diluída e o volume da solução mais concentrada de que se partiu. Assim, tentámos aplicar os conhecimentos teóricos que adquirimos nas aulas relativos às soluções e às composições quantitativas. Objetivos da ExperiênciaA presente atividade prático-laboratorial teve como objetivos centrais a: . Preparação de uma solução inicial de sulfato de cobre penta-hidratado (CuSO4.5H2O) de concentração 0,020 mol/dm3; . Preparação de uma solução diluída de 50,0 ml a partir da solução anterior, com factor de diluição 4. ATIVIDADE EXPERIMENTALMATERIAL, equipamento e REAGENTES: Material laboratorial: . Balança analítica de precisão ± 0,01g . 2 Balões volumétricos de 50 ml; . Vidro de relógio; . Esguicho com água desionizada; . Espátula; . Pipeta volumétrica de 25 ml; . Proveta de 25 ml; Reagentes: . Sulfato de cobre penta-hidratado (CuSO4.5H20). Procedimento Experimental: A. Pesagem do soluto: 1. Com a ajuda de uma espátula, colocou-se gradualmente o soluto no vidro de relógio. 2. Tentou obter-se um valor próximo do pretendido (2,50 g); 3. Não se retirou o excesso de sólido; 4. Registou-se o valor exacto da massa. B. Dissolução do sal: 1. Adicionou-se cerca de 25 ml de Água desionizada ao copo que contém sal; agitou-se até completa dissolução; 2. Transferiu-se a solução para o balão volumétrico; 3. Lavou-se a vareta, o copo e o funil com pequenas porções de água desionizada e transferiu-se posteriormente estas águas de lavagem para o balão; 4. Adicionou-se água desionizada até ao traço de referência; 5. Agitou-se até homogeneizar; 6. Transferiu-se a solução para um frasco de vidro devidamente lavado e passado pela solução recém-preparada; 7. Rotulou-se o frasco, indicando a concentração exacta da solução, calculada a partir da massa utilizada. C. Preparação de soluções diluídas de 50,0 ml de solução diluída a partir da solução anterior, de um factor de diluição 4. 1. Mediu-se com uma pipeta volumétrica 25 ml de solução anterior e transferiu-se para um Balão Volumétrico de 50 ml; 2. Adicionou-se água desionizada até ao traço de referência; 3. Agitou-se até homogeneizar; 4. Rotulou-se devidamente, indicando a sua concentração molar. CÁLCULOS PRÉVIOSSituação A: Preparação de uma solução inicial de sulfato de cobre penta-hidratado (CuSO4.5H2O) de concentração 0,020 mol/dm3; Dados: . CuSO4, 5H2O . V = 100 cm3= 100 ml . C = 0.020 mol/dm3 1. Determinação da massa molar correspondente ao sulfato de cobre penta-hidratado: MR (CuSO4.5H2O) = Ar (Cu) + Ar (S) + Ar (O) x 4 + Ar (H) 10 + Ar (O) x 5⇔ ⇔ MR (CuSO4.5H2O) = 63, 55 + 32,07 + 16,00 x 4 + 1,01 10 + 16,00 x 5 ⇔ MR (CuSO4.5H2O) = 63,55 + 32,07 + 64,00 + 10,10 + 80,00 ⇔ MR (CuSO4.5H2O) = 249,71 M (CuSO4.5H2O) = 249,71 g/mol 2. Determinação da quantidade de soluto (n) na solução a preparar a partir da definição de concentração: C=n/v C= 0,02 mol/dm3 V= 50 cm3 ⇔ V = 50 x 10-3 dm3 C=n/v ⇔
⇔ n
= C
⇔ n
=
0,020 ⇔ n = 0,001 mol
3. Cálculo da massa
do soluto a partir da relação: m = n m = n x M ⇔
⇔ m
=
0,001 ⇔ m = 2,50 g* *Nota: Nesta fase do trabalho experimental foi cometido um erro acidental, relativo ao cálculo da massa do soluto. O valor real é 0,25 g, pois 0,001 x 249,71= 0,25, mas devido a este erro obteve-se 2,50 g. Deste modo e como o erro não foi solucionado a tempo da atividade, os resultados finais serão em função do valor da massa do soluto = 2,50 g. Situação B: Preparação de uma solução diluída de 50,0 ml (50 cm3), a partir da solução anterior, com factor de diluição 4. Dados: . Vfinal (Vf) = 50,0 ml = 50,0 cm3; . Factor de diluição = 4 . Vinicial= ? 1. Cálculo do volume inicial (Vi): f =Vf / vi ⇔ ⇔ 4 = 50 / vi ⇔ Vi = 50 / 4 ⇔ Vi = 12.5 ml Registo de resultadosPesou-se a substância, numa Balança de precisão ± 0,01 g, a fim de se perfazer a massa de CuSO4.5H2O = 2,50 g.
Cálculos Finais1. Cálculo da Concentração da solução final (cf.): f = Ci / Cf ⇔ ⇔ Cf = 0,20 / 4 ⇔ Cf = 0,05 mol/dm3 Discussão de resultadosPara se realizar a discussão dos resultados obtidos, é necessária a observação destes dois diagramas de fluxo, relativos a esta atividade prático-laboratorial (Figs.1 e 2).
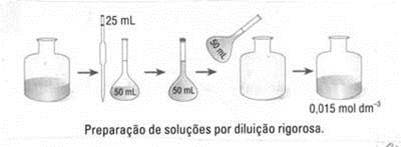
Fig.1: Preparação de soluções por diluição rigorosa.
Fig.2: Preparação de soluções a partir de soluções anteriores. Em primeiro lugar, no meu entender, como diluição foi feita a partir duma solução realizada anteriormente a esta, poupou-se o soluto (CuSO4.5H2O) evitando gastos desnecessários, ou seja, não foi feita uma nova solução, mas sim aproveitou-se a solução já preparada para fazer uma diluição, como consta nos objectivos desta atividade. Através da análise das Figuras1 e 2 e tendo em conta o erro de cálculo cometido nos cálculos prévios (massa do soluto) podem ser discutidos os seguintes aspectos: . Os resultados que obtivemos variam minuciosamente conforme o erro do material utilizado e dos erros cometidos durante as medições pelo operador; . Deve-se salientar ainda que há uma grande probabilidade de serem outros cometidos erros de leitura e observação, por exemplo quando se observa uma medida na vertical e não na horizontal, sendo a última a posição correcta . A solução final ficou mais clara do que a inicial, visto que estava menos concentrada (pois é uma solução diluída; ObservaçõesUm dos pormenores que merece o meu destaque, pois se revelou importante no decurso da atividade laboratorial, é o devido conhecimento do método de observação correcta das medições aos olhos dos operadores, isto é, a realização de uma visualização correcta (Fig.3).
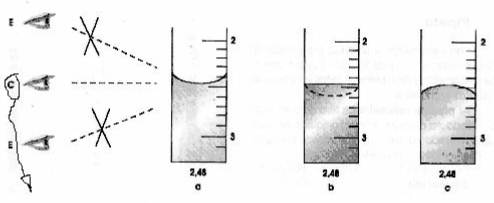
Fig.3: Esquema-síntese representativo da leitura correcta de medições aos olhos do operador. É útil ainda referir as regras de segurança a ter com o CuSO4.5H2O (sulfato de cobre pentahidratado): . Manter fora do alcance das crianças; . Nocivo por ingestão; . Irritante para os olhos e para a pele; . Usar bata e luvas de protecção. ConclusõesNa actividade prático-laboratorial, testámos dois tipos de soluções: concentradas e diluídas. Assim, quanto maior for a quantidade de soluto presente num dado volume de solução, maior é a sua concentração. Por isso, nas soluções mais concentradas existe maior quantidade de soluto do que nas soluções diluídas, para um mesmo volume de solução. Nas atividades laboratoriais que foram efectuadas, o soluto utilizado foi o Sulfato de Cobre pentahidratado (CuSO4. 5H2O). Pode concluir-se, então, que a cor deste mesmo na solução inicial, era mais forte, visto ser a mais concentrada e, mais clara, na solução final, visto que sofreu um processo de diluição Por fim, avalio positivamente o trabalho do meu grupo, ao longo deste processo, pois apesar do erro de cálculo cometido no inicio da actividade prático-laboratorial, conseguimos superar todos os desafios e objectivos propostos e adquirir, experiência laboratorial principalmente ao nível de manuseamento de materiais e ao aprofundamento do conhecimentos dos distintos métodos de preparação de soluções. Referências Consultadas. http://www.pdamed.com.br/diciomed/pdamed_0001_15253.php
.
http://fq.no.sapo.pt/download/Tiago_Afonso_TLQ10_%20Solucoes_e_
. http://users.prof2000.pt/users/norberto/Amadora_02_03/10_ANO/TURMA Outros Trabalhos Relacionados
|
|
||||||||||||||