|
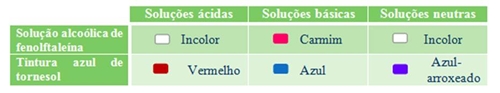
1. Objectivo do trabalho . Estudar as reacções ácido-base. . Observar como varia o pH de uma solução ácida, à medida que se lhe adiciona uma solução básica. 2. Introdução teórica Muitas das substâncias que nos rodeiam dissolvem-se bem na água. As soluções que se obtêm podem ser: ácidas (ex. limonada), básicas (ex. limpa-vidros) ou neutras (ex. água açucarada). Para se saber o carácter químico de uma solução, recorre-se a substâncias chamadas indicadores de ácido-base. Algumas destas substâncias mudam de cor na presença de soluções ácidas, outras na presença de soluções básicas. Os dois indicadores mais utilizados são a tintura azul de tornesol e a solução alcoólica de fenolftaleína que adquirem as cores representadas no esquema seguinte:
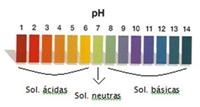
No caso de se querer comparar duas soluções, por exemplo ácidas, estes indicadores não nos permitem dizer qual é a mais ácida. Nesse caso, podemos medir o pH das soluções utilizando um aparelho medidor de pH, para obter um resultado mais rigoroso, ou utilizando o indicador universal, para obter um resultado aproximado. O indicador universal, conforme o pH, adquire o conjunto de cores representado no seguinte esquema:
Quando se põe em contacto uma solução ácida e uma solução básica ocorre uma reacção química - reacção de ácido-base - que faz alterar a acidez das soluções ácidas e a basicidade das soluções básicas.
Os químicos fizeram muitas
reacções de ácido-base e chegaram à conclusão que obtinham sempre:
3. Material e reagentes Material: Reagentes: . pipeta graduada; . ácido clorídrico . tubo de ensaio; . hidróxido de sódio . vareta de vidro; . solução alcoólica de fenolftaleína . pompete; . papel indicador universal . pinça de madeira. 4. Esquema de montagem
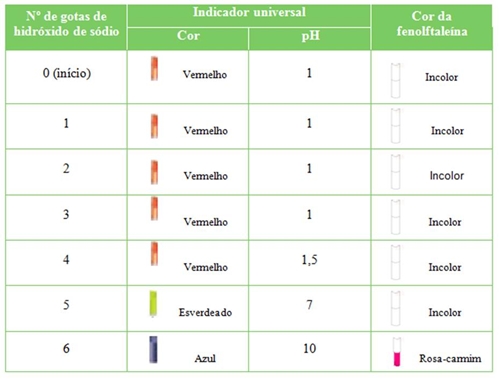
5. Procedimento experimental 1. Colocar 1mL de ácido clorídrico num tubo de ensaio; 2. Introduzir a extremidade da vareta na solução; 3. Molhar o papel indicador com a extremidade da vareta; 4. Comparar com a escala, registando o valor de pH associado à cor que o papel apresenta; 5. Adicionar duas gotas de solução alcoólica de fenolftaleína; 6. Repetir os passos 2, 3 e 4; 7. Adicionar gota a gota hidróxido de sódio ao tubo de ensaio, repetindo os passos 2, 3 e 4; 8. Registar todas as observações. 6. Registo de dados e observações No nosso trabalho experimental utilizámos dois indicadores: o indicador universal e a fenolftaleína. No quadro seguinte encontram-se resumidas as nossas observações, relativamente à cor dos indicadores e aos valores de pH que obtivemos. Observámos, também, que à medida que íamos adicionando o hidróxido de sódio, gota a gota, se ia formando, no fundo do tubo de ensaio, um sólido branco. 7. Conclusão e Crítica Através da análise dos resultados, podemos verificar que a nossa solução, que no princípio era muito ácida, se foi tornando cada vez menos ácida quando lhe adicionámos o hidróxido de sódio, pois o pH foi subindo. A solução no final da experiência já era básica pois mudou a cor da fenolftaleína para rosa-carmim. Podemos assim concluir que a acidez de uma solução diminui quando se lhe adiciona uma solução básica.
Como a reacção química que
realizámos foi entre o ácido clorídrico e o hidróxido de sódio,
obtivemos como produtos da reacção o cloreto de sódio (sal) e água. O
esquema de palavras que traduz a reacção química, é o seguinte: Ácido Clorídrico + Hidróxido de Sódio ---- Cloreto de Sódio + Água
Consideramos que foram alcançados os objectivos propostos ,pois observámos que o pH aumenta à medida que adicionamos uma solução básica a uma solução ácida, e que uma reacção entre um ácido e uma base dá origem a um sal e água. Gostámos de realizar este trabalho experimental, pois ajudou-nos a perceber melhor a matéria e permitiu-nos trabalhar com o material de laboratório. 8. Bibliografia . PIRES, Isabel e RIBEIRO Sandra, Universo da Matéria, Lisboa, Santillana Constância, 2007; . CAVALEIRO, M. Neli, BELEZA, M. Domingas, FQ 8 – Sustentabilidade na Terra, Edições ASA, 2007; . Caderno de apontamentos de Ciências Físico-Químicas. Outros Trabalhos Relacionados
|
|