|
Uma reacção acido base é uma mistura homogénea de substancias em que solvente é a água. O solvente e a s substâncias que dissolve, ao passo que o soluto é ou não a substância dissolvida pelo solvente. As soluções aquosas podem ser de três tipos: ácidas, básicas (ou alcalinas) ou neutras. . As soluções aquosas ácidas são soluções que contêm solutos que são ácidos. . As soluções aquosas básicas contêm solutos que são bases . As soluções aquosas neutras não teem ácidos nem bases ou, então contêm ácidos e bases em quantidades tais que os seus efeitos se anulam.
As propriedades dos ácidos podem ser neutralizadas (anuladas) pelas bases e vice-versa. Tanto os ácidos como as bases desempenham papéis fundamentais na indústria e na agricultura, estando envolvidos em numerosíssimas reacções químicas a que se dá o nome de reacções de ácido base. E aqui estão vários exemplos de ácidos base.
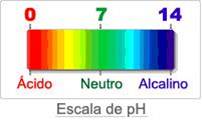
Todos os solutos neutros são substancias que, mesmo quando puros, são neutros. Também a água pura é uma substância neutra. Como é que podemos saber se uma solução aquosa ou uma substância é ácida, básica ou neutra? Existem duas formas: . Determinar o chamado pH* da solução aquosa; . Usar um indicador de ácido-base. *A escala de pH (‘‘p’’ minúsculo e ‘’H‘’ maiúsculo). Se a temperatura da solução for igual a 25ºC, podemos dizer que o pH de uma dada solução é um número que varia entre 0 e 14; . Qualquer solução que apresente pH menor que 7 é ácida e quanto mais baixo for o pH, maior será a acidez da solução; . Qualquer solução que apresente pH igual a 7 é neutra; . Qualquer solução que apresente pH maior que 7 é básica e quanto mais alto for o pH, maior será a basicidade (ou alcalinidade) da solução.
Alguns exemplos de soluções de pH, neutro, básico, ácido: . Sangue pH 7,4 à solução básica (pouco) . Lixívia, pH=13 à solução básica (elevado) . Sumo de laranja, pH=2 à solução ácida . Alimentos do estômago, pH =1 à Solução ácida ( elevado)
Os indicadores mais usados nos laboratórios são a fenofetalina e a tintura de tornesol e o chamado indicador base. A adição de ácidos base altera o pH de soluções de modo que são evidentes: . A adição de um ácido a uma dada solução diminui o pH dessa solução; . A adição de uma base a uma dada solução aumenta o pH dessa solução. A adição de um ácido base vai dar origem a uma reacção química conhecida por "reacção de neutralização" De facto, quando se adiciona um ácido a uma base obtemos duas substancias diferentes: um sal ( que como já vimos é uma substancia cujas unidades estrutura são iões) e água. De uma forma geral Ácido (aq) + Base (aq) à Sal (aq) + água (l) Como tanto cloreto de sódio (sal de cozinha) como a água são substancias neutras, então a adição do ácido base vai resultar na tal neutralização. Uma reacção de ácido-base nem sempre resulta de uma neutralização. Conclusão: Com este trabalho fiquei informada sobre o que é um ácido base (substancia alcalina) e uma solução neutra. Quais os indicadores que existem as escalas de pH e quando uma solução é mais ou menos básica e quando é que é mais ao menos ácida. Bibliografia: . http://html.rincondelvago.com/files/7/9/7/0005779710.jpg . http://i111.twenga.com/11/tp/75/57/5496030635784727557.png . http://www.haskellcosmeticos.com.br/Image/escala%20ph.JPG . Manuais virtuais. Outros Trabalhos Relacionados
|
|
||||||||||||||||||||||||||||||||||||||||||||||